Вирулентное действие солнечного излучения на границе диапазонов UVB-UVA
Вирулентное действие солнечного излучения на границе диапазонов UVB-UVA
Аннотация
Представлены результаты анализа частоты вирусных пандемий с 2008 г. по 2019 г., включающих статистику геморрагической лихорадки Эбола, гриппа AH1N1, AH7N9 и коронавируса MERS-CоV и инфицированных ВИЧ-1 пациентов в Российской Федерации с 1996 г. по 2019 г. (23–24 циклы солнечной активности) с интенсивностью солнечного излучения на длине волны ~λ315 nm, представляющая границу диапазонов UVB (280–315 nm) и UVA (315–400 nm), а также границу кривой относительной спектральной бактерицидной эффективности (205–315 nm). Установлена тесная связь вирусных пандемий и ВИЧ-инфицированных пациентов (всего ~ 100000 человек) с изменением интенсивности ~λ315 nm (r ~ 0.85) в циклах солнечной активности. Сделан вывод о вирулентном воздействии солнечного излучения ~ 315 nm на развитие вирусных пандемий.
1. Введение
Посвящается труду А.Л. Чижевского
«Эпидемические катастрофы и периодическая деятельность Солнца» (1930 г.)
Изменения спектральной солнечной светимости на участке приходящего к земной поверхности излучения UVB (297–315 nm) — UVA (315–400 nm) обусловлены глобальными солнечными механизмами с временным диапазоном от минут до десятилетий. К ним относятся:
1) солнечные осцилляции, воздействующие на UVB-UVA с частотой «пятиминутных колебаний»
;2) вращение солнечной атмосферы (~ 27 сут);
3) 11-летний цикл солнечной активности (СА), с которым тесно коррелирует излучение UVB .
В работе , посвященной анализу связи глобальных эпидемий (Global Epidemics, GE), вызванных вирусом лихорадки Эбола, гриппа AH1N1, AH7N9 и коронавируса MERS-CоV, с изменением солнечной активности (СА) в 24 цикле, получена корреляция динамики GE с излучением UV (r~0,83) на границе кривой относительной спектральной бактерицидной эффективности λ315 nm, представляющая также границу диапазонов приходящего к земной поверхности солнечного ультрафиолета UVB (280–315 nm) и UVA (315–400 nm). На рис. 1 представлена гистограмма интенсивности ~ λ315 nm и годовых значений GE, за период с 2008 г. по 2019 г. (24 цикл СА) по данным с сайтов Umweltphysik IUP
и World Health Organization . Значения GE на левой оси ординат рис. 1 представляют суммарную частоту вспышек высокопатогенных вирусов геморрагической лихорадки Эбола, гриппа AH1N1, AH7N9 и коронавируса MERS-CоV (родственный SARS-CoV-2).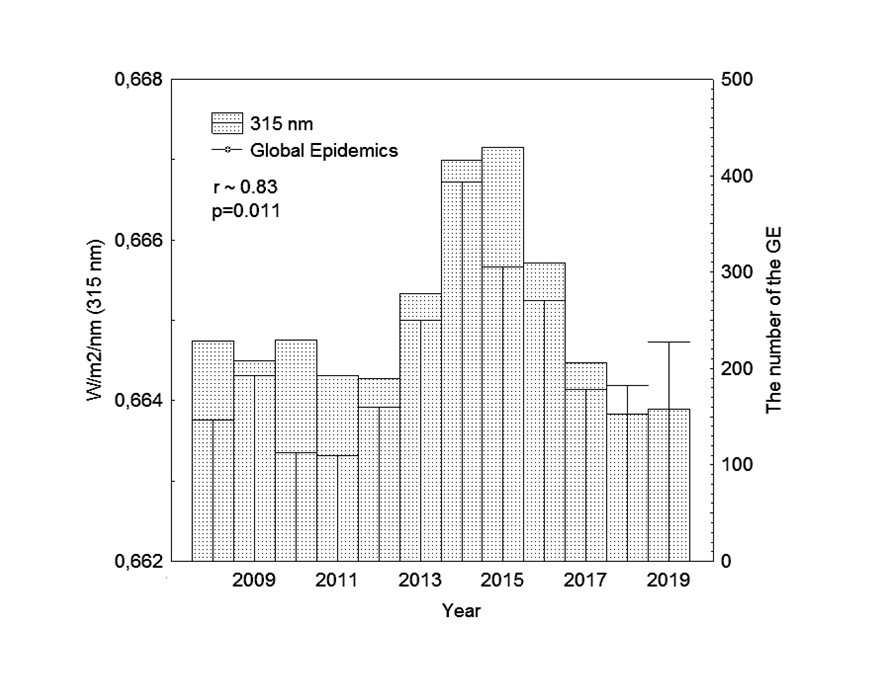
Рисунок 1 - Гистограмма случаев вирусных пандемий (Global Epidemics, GE) и интенсивности солнечного излучения на границе диапазонов UVB-UVA (λ315 nm) с 2008 г. по 2019 г. (24 цикл СА)
Для подтверждения выводов о связи различных групп вирусов с излучением UV в 24 цикле СА мы использовали данные по численности ВИЧ-инфицированных в Российской Федерации за период с 1997 г. по 2019 гг. (https://www.crie.ru/). Данные по интенсивности λ315nm выбирались на сайте https://lasp.colorado.edu/. В качестве показателя СА выбран композитный индекс MgII (280 nm), характеризующий глобальное изменение UV на Солнце в 11-летнем цикле СА (https://www.iup.uni-bremen.de/deu). Статистика вируса иммунодефицита человека ВИЧ-1 (HIV-1) в значение суммарной частоты не применялась, т.к. ВИЧ-1 отличается от вышеупомянутых вирусов повышенной мутагенностью, скоростью размножения, поражением клеток «первой линии защиты» иммунной системы (лимфоциты Т-хелперы-1, макрофаги и нейтрофилы), последующей иммуносупрессией и активацией ранее «спящих» патогенов. Последнее может привести к гибели организма человека, как итогу медленно развивающегося комплексного заболевания СПИД. Описанные особенности HIV-1 предполагают существование как специфических, так и общих с другими вирусами механизмов влияния интенсивности излучения границы UVB-UVA на вирулентность HIV-1.
2. Результаты
Использовались данные по численности HIV-1 инфицированных пациентов в РФ за период с 1997 г. по 2019 г. (всего ~ 100000 человек). Данные выбирались на сайтах www.hivrussia.info/dannye-po-vich-infektsii-v-rossii и www.lasp.colorado.edu. В качестве показателя СА выбран композитный индекс MgII (280 nm), характеризующий изменение интегрального UV в солнечной атмосфере . В итоге обработки данных на рис. 2а представлено распределение численности HIV-1 инфицированных (по годовым значениям) с линейным трендом, обусловленным ростом парентеральных контактов при употреблении наркотиков, и без тренда. С последним сопоставляли ход интенсивности λ315 nm (рис. 2b) и композитного индекса Mg ll (рис. 2с). На рис. 3 представлено аналогичное рис. 2 сопоставление HIV-1 и частоты вирусных пандемий (GE) на фоне излучения λ315 nm (23–24 циклы СА). Пунктиром GE обозначено вероятное изменение GE в 23 цикле СА, т.к. статистика по GE за данный период в архиве WHO не найдена . Как видно на рисунке графики демонстрируют идентичность хода годовых значений GE и HIV-1.
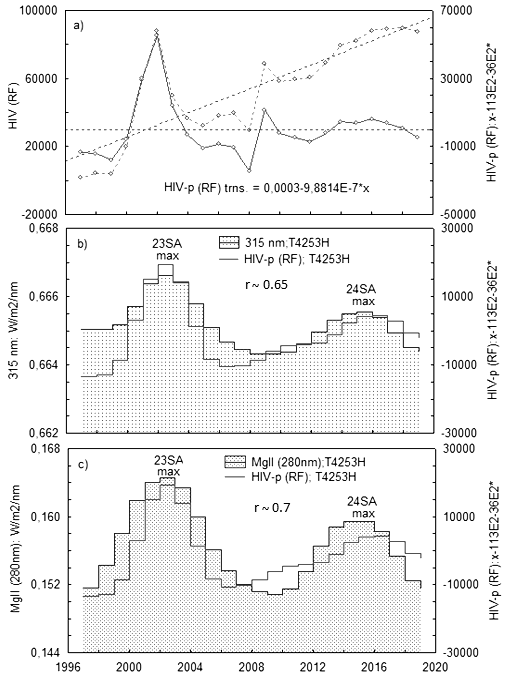
Рисунок 2 - Временной ряд HIV-1-инфицированных пациентов в РФ с линейным трендом, обусловленным ростом парентеральных контактов при употреблении наркотиков, и без тренда (a); сопоставление временного хода HIV-1 с излучением ~λ315 nm в интервале 23–24 циклов СА (b); сопоставление хода HIV-1 с композитным индексом Mg II (280 nm) в интервале 23–24 циклов СА (с)
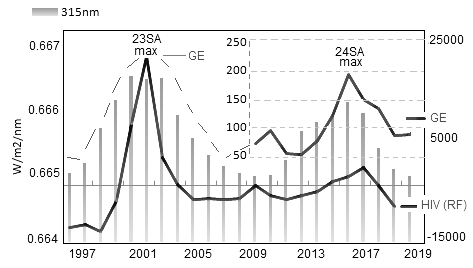
Рисунок 3 - Сравнение численности HIV-1-инфицированных в РФ и частоты планетарных пандемий (GE) на фоне излучения λ315 nm за период 1997–2019 гг. (23–24 циклы СА)
3. Энергия диапазонов UVB-UVA в фотобиологических процессах
Механизм бактерицидного эффекта UV в отношении разных вирусов заключается в повреждении его нуклеиновой кислоты, что блокирует размножение. Однако энергия квантов UVB-UVA способна запускать в клетках «хозяина» несколько типов сходных «обходных» путей, облегчающих размножение вируса и, одновременно, снижающих иммунорезистентность организма:
1. UVВ и цитокины. Известно, что медиаторами межклеточного взаимодействия в иммунной системе человека являются про- и противовоспалительные цитокины, а также EGF — эпидермальный фактор роста . Например, после облучения UVB кератиноциты эпидермиса секретируют цитокин IL-10 (Interleukin-10), подавляющий антиген-презентацию клетками Лангерганса, — иммунными клетками кожи. Кроме того, UVB подавляет секрецию лимфоцитами (Т-хелперами-1) ряда про-воспалительных цитокинов: IL-1,-6,-12 и фактора некроза опухоли альфа (TNFa)
, . Последнее, совместно с пролиферативным эффектом EGF, создает условия для онкогенеза.2. UVA и Митохондрии (МТХ). В МТХ кератиноцитов и фибробластов кожи, а также в МТХ Т-хелперов-1 UVA способствует образованию синглетного кислорода, супероксид аниона и АКМ. Они вызывают перекисное окисление липидов и трансформацию белков мембран иммунокомпетентных клеток (мишеней для HIV-1) с их последующим апоптозом , чем облегчают подавление иммунного ответа этим вирусом.
3. UVB-UVA, МТХ и Translocator protein (TSPO). Белок TSPO 18 kDa, поглощая фотон UV, транспортирует холестерин между мембранами МТХ и обеспечивает его взаимодействие со стероидогенным фактором StF-1 и последующий синтез стероидных гормонов в клетках стероидогенных тканей ,
, . Ключевая роль TSPO в стероидогенезе обусловливает его участие в стероид-зависимом контроле иммунного ответа, стресс-адаптации, клеточной пролиферации и апоптозе.В а,б,с- путях ключевой структурой являются МТХ — «генератор энергии» клетки, что важно для взаимодействия разных путей опосредования эффектов UV (внеклеточного источника энергии) и адаптивного варьирования их одновременного или последовательного действия. Например, энергетическая «цена» полимеризации TSPO при λ254 nm требует участия АКМ
, , тогда как при λ302 nm такой необходимости нет. Далее, интенсивность λ302 nm в 120–360 J/m2 вызывает полимеризацию ТSРО и усиленный стероидогенез, при увеличении интенсивности до 480 J/m2 той же длины волны происходит деполимеризация белка и снижение его стероидогенной функции . Описанные особенности изменения структуры и функций UV-чувствительного белка TSPO в клетках животных и человека объясняют полученные в данной работе факты зависимости числа инфицированных HIV-1 и числа вирусных пандемий от интенсивности границы диапазонов UVB-UVA (~ λ315 nm) в 11-летнеем цикле СА. Если фоточувствительные процессы в МТХ усиливают ацидоз, создавая условия для проникновения вируса в клетки-мишени и его размножения, то мишени UV в цитоплазме и ядре реализуют и другие эффекты, например, для витаминов Д3, В2 (рибофлавина), а также криптохромов:1. UVB и витамин D3. Синтез витамина 1,25(ОН) D3 начинается в кератиноцитах кожи под влиянием UVB
. Рецептор витамина D3 является транскрипционным фактором, действующим совместно с рецептором гормонов щитовидной железы — три- и тетра-йодтиронинов (усилители синтеза АТФ в МТХ). Витамин D3 необходим для усвоения кальция и фосфора в костной ткани и Са-зависимой активации иммунокомпетентных клеток. Поскольку Са2+ при ацидозе играет роль буфера, то витамин D3 противодействует эффектам HIV-1.2. UVB и FAD-содержащие белки цитоплазмы. Фотоны излучений диапазонов UVB-UVA в клетке-мишени для вируса могут активировать фоточувствительные белки, содержащие последовательность флавинаденилдинуклеотид (FAD, ко-фактор многих окислительно-восстановительных реакций). У животных и человека наиболее известны криптохромы CRY1/CRY2 и витамин В2 или рибофлавин, содержащий FAD в комплексе с флавинмононуклеотидом (FMN). Криптохромы CRY1-CRY2 у животных и растений входят в состав молекулярного внутриклеточного механизма поддержания циркадианного (околосуточного) ритма жизнедеятельности. При активации фотоном FAD в составе CRY1 он с помощью своего неспаренного электрона последовательно взаимодействует с цепочкой остатков аминокислоты триптофана в молекуле CRY, каждый раз образуя пару радикалов FAD-Trp, обладающую магнито-чувствительностью. Так, под влиянием фотонов UV белок приобретает функции фото- и магнито-сенсора
, а также становится первопричиной появления цепей свободных радикалов и нарастания в клетке ацидоза, облегчая размножение вируса. В составе рибофлавина FAD, активированный фотоном UVB, также может быть причиной роста концентрации свободных радикалов, разрушающих структуры внеклеточных вирусов и тем самым угнетающих их и блокирующих распространение патогена. Это может быть универсальным механизмом угнетающего действия рибофлавина, под воздействием света в отношении вирусов, микробов, грибов и паразитов . Вместе с тем, рибофлавин активирует иммунную защиту организма, обусловливая совместно с криптохромами суточные и сезонные ритмы активности иммунной системы. Благодаря вариациям UVB-UVB в 11-летнем цикле СА, инфрадианные многолетние макроритмы активности иммунной защиты и вирусных пандемий могут быть прогнозируемы . В свою очередь, усиление интенсивности UVB-UVA в ходе цикла СА является необходимым условием для формирования вирусных пандемий.4. Заключение
В целостной картине воздействия Солнца на патогенную среду излучение UVB играет роль фотобиологического фактора. Основным источником энергии для вирусов являются окислительно-восстановительные реакции клеток организма хозяина, опосредующих действие UVB-UVA. Вирусы не обладают способностью к продукции энергии, однако вопрос об использовании ими энергии СА и наличии в их структуре фоточувствительных белков остаётся открытым (в геноме вируса обнаружен ген родопсина, но не белок).
Обобщая рис. 3 следует вывод о высокой чувствительности различных вирусов к интенсивности на длине волны ~ λ315 nm, определяющей условие для начальной стадии интенсификации (или редукции) патогенной среды.
Если рассматривать «вирус и окружающие его клетки хозяина» как единую двухкомпонентную систему, опосредующую влияние UVB, то можно проследить черты её адаптации к солнечным факторам. Они проявляются, например, в появлении свойств магнито-сенсора у белка криптохрома (CRY1) после облучения UVB. Другой пример — бистабильность UV-воспринимающих белков человека CRY1 и опсина 5 (OPN5), проявляющаяся в сочетании одновременной или последовательно сменяющейся чувствительности к излучению оптического диапазона солнечного спектра . При этом UV-чувствительные белки выступают в роли фотосенсибилизатора, который вызывает возникновение ионизированных форм кислорода , свободных радикалов и в основном усиливает действия патогена. «Совмещение» свойств фото- и магнитосенсоров у ключевых для метаболизма белков, является, по-видимому, также одной из адаптаций живых организмов к воздействию излучения UVB на границе ~ λ315 nm. Не исключено, что реакция вирусов на излучение различных длин волн в диапазоне UVB (280–315 nm) может усиливаться/уменьшаться за счет региональных особенностей орографии и атмосферы.
